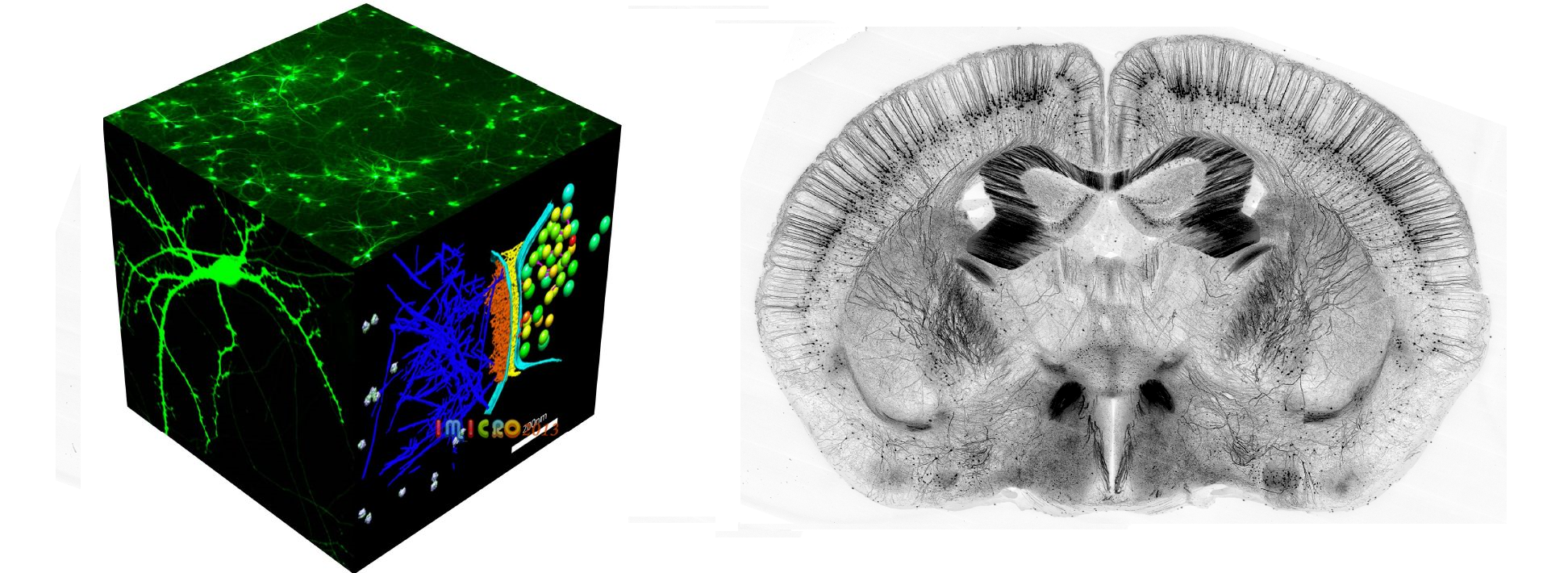
共聚焦激光扫描显微技术
一般荧光显微镜对于薄样品 可获得清晰的图像,但当样品较厚时,物平面之外的荧光分子也会被激发,而这些光在像平面上是弥散的,因而干扰成像质量。二十世纪五十年代,Minsky发 明了共聚焦显微成像方法,但直到上个世纪七十年代,激光光源和计算机技术的发展才使共聚焦技术真正得以实现。共聚焦的含义就是将聚焦平面以外的成像信息过 滤,使其不在最终的成像结果中显示,首先将光线聚焦于一点或一线,然后对所要观察的平面进行扫描,焦平面以外的光线通过检测针孔隔除。
双光子激光扫描显微技术
1931年,物理学家梅耶(Maria Goppert-Mayer (1906-1972))在她的博士论文中提出多光子激发的概念。其基本原理是当激发光子的密度足够高时,原子与分子一次能同时吸激发光的两个光子乃至多个光子而跃迁到高能级。
超短脉冲锁模激光器的问世为多光子激发荧光染料分子提供了必要的高瞬时能量密度。以锁模激光器为光源,Denk 和 Webb 在九十年代发明了双光子扫描显微技术,其基本光路于一般扫描显微镜相仿,但用大约两倍于单光子激发波长的低能量光子来激发染料分子的荧光。由于双光子激发 需要极高的能量密度(激发效率与光子密度的平方成正比),只有在焦点上才有足够的双光子吸收导致有荧光发出,而焦平面之外的染料分子则根本不会吸收低能激 发光子。因此不需要共聚焦针孔,也能获得清晰的焦平面荧光图像,并且由于同样的原因,焦平面之外也不会发生光漂白与光毒效应。再者,因为提高了激发光波 长,所以激发光的散射效率减小,所以它对于生物样品的穿透能力就增加了许多。这些特性也使得我们可以更好地观察神经细胞与组织的电活动与形态在特定的生 理、病理条件下的动态变化,极大地推动了神经生物学的前沿进展。
超高分辨率荧光成像技术
普通的光学显微镜将我们的人眼分辨率提高了几百倍,看见了我们未曾看见的尺度。随着生命科学的发展,人们需要看见细胞内部超微尺度的生命活动的现 象。普通的光学显微技术因为光学衍射极限的限制而不能满足这一需求,而各种电子显微技术对样品制备的要求也限制了其应用范围。近几年来,人们在光学显微研 究中的一系列努力取得了新的突破,陆续发明了一些可以超越衍射极限的方法,如近场光学显微镜(NSOM)、受激发射耗损技术(STED)、光活化定位显微 镜(PALM)等等,在这里,着重介绍一下2006年刚刚发展起来的随机光学重建技术(STORM)。
一般说来,远场光学显微镜包括共聚焦和双光子显微镜受光学衍射极限的理论限制,它的分辨尺度受波长束缚,因此人们无法看清小于~200nm的生命结构与现 象,对于了解生命科学的本质十分不利,这无疑成为了生物光学成像的最大障碍。近场光学显微镜可以克服衍射限制,但局限是不能够探测样品内部的结构,而且其 探针易于对样品造成损伤。
由于CCD等光学检测器的灵敏度的提高,人们在近十几年已成功地进行了许多单分子荧光实验。单个发光分子的像实际上是一个高斯形态的点扩散函数, 只要探测到的光子数足够多,由计算机算出这高斯函数的中心位置作为该分子的成像位置就可以有足够高的精度。因此,单分子荧光成像技术的使得突破衍射极限的 观察限制有了理论上的可行性。
生物荧光成像通常涉及大量分子。若同时激发这些分子的荧光,它们的点扩散函数将互相叠加,因而成像的分辨率将受到经典衍射极限的限制。随机光学重 建以及光活化定位显微的基本思想是利用一种可控开关的荧光物质,这种荧光物质在受到不同波长的光子激励下可以进入可吸收激发光子发光的正常状态或不能发光 的暗状态。这样,在所有荧光分子都进入暗状态之后,可以用很弱的激励光随机地将小部分分子“打开”并进行正常荧光成像测量。只要这些分子足够稀少,其相应 的点扩散函数就不会重叠,也就可以分析出这些点扩散函数的中心位置,从而得到每个分子的精确位置。在此之后用另一种激励光将这些“打开”的分子“关闭”或 漂白,就可以重新随机地“打开”并定位另外一小部分分子。如此循环操作,利用单分子荧光成像的方法“逐个”记录每个荧光点的位置,最后可以重建整个样品的 超高分辨率荧光图像。这种方法问世时间不长,尽管由于速度限制,目前还只能用于固定组织样品,但是已经在显微的清晰能力发面初显威力,但它的分辨能力已经 达到了20nm。
在随机光学重建显微镜中,可以利用不同的荧光物质来实现多色成像,还可以利用散光效应,通过记录在CCD上的点扩散函数分布的椭圆率来确定荧光的 轴向位置,进而实现随机光学重建的三维成像。利用这种方法所拍摄的生物图像的横向分辨能力达到了20-30nm,轴向分辨能力达到了50-60nm。随着 荧光材料与检测器的发展,其分辨率还会不断提高,应用范围也会进一步扩大。